Sifat ini mencakup penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik, semuanya bergantung pada jumlah partikel zat terlarut, bukan jenis zat terlarutnya. Dengan lebih lanjut memahami sifat koligatif di bawah ini, kita dapat lebih mengapresiasi dan memanfaatkan fenomena kimia yang terjadi di sekitar kita.
Pengertian Sifat Koligatif Larutan
Mengutip repositori.kemdikbud.go.id, sifat koligatif larutan adalah sifat larutan yangtidak bergantung pada jenis dan ukuran zat terlarut, tetapi hanya bergantung pada jumlah partikel zat terlarut.
Sifat koligatif berpaku pada kuantitas, bahwa semakin banyak zat terlarut yang larut dalam larutan, semakin besar pula sifat koligatifnya. Maka dari itu, sifat koligatif ini tidak memperhatikan kualitas atau jenis zat terlarutnya, sedangkan sifat-sifat larutan seperti rasa, warna, dan kekentalan (viskositas) masih bergantung pada jenis zat terlarutnya.
Agar suatu larutan memiliki sifat koligatif, harus memenuhi dua asumsi berikut:
- Zat terlarut tidak mudah menguap sehingga tidak memberikan kontribusi pada tekanan uapnya
- Zat terlarut tidak larut dalam bentuk padat
Contohnya adalah larutan garam (NaCl), di mana ketika dilarutkan dalam air atau NaCl(s) + H2O(l) → Na+(aq) + Cl–(aq). Senyawa NaCl terionisasi menjadi ion Na+ dan Cl-.
Sebaliknya, larutan nonelektrolit tidak dapat menghantarkan arus listrik karena molekul-molekul terlarutnya tidak terionisasi di dalam larutan. Contohnya adalah larutan gula seperti glukosa, sukrosa dan maltosa, larutan urea (CON2H4), serta larutan alkohol seperti metanol, etanol dan propanol.
Larutan elektrolit sendiri terbagi menjadi dua jenis, yaitu elektrolit kuat dan elektrolit lemah. Masing-masing memiliki perbedaan dalam kemampuannya untuk mengionisasi dalam larutan.
Perbedaan jenis larutan ini juga memengaruhi sifat koligatif larutan, yang terbagi menjadi sifat koligatif larutan elektrolit dan nonelektrolit. Kedua jenis sifat koligatif ini memiliki ciri dan perbedaannya sendiri, serta rumus yang berbeda pula.
4 Macam Sifat Koligatif Larutan
Mengutip mplk.politanikoe.ac.id, sifat koligatif larutan meliputi empat macam dan hanya bergantung pada jumlah partikel zat terlarut, yaitu:1. Penurunan Tekanan Uap (ΔP)
Penurunan tekanan uap terjadi ketika zat terlarut non-volatil (tidak mudah menguap) ditambahkan ke dalam pelarut. Molekul-molekul zat terlarut menghalangi molekul-molekul pelarut untuk berubah menjadi fase gas, sehingga mengurangi jumlah molekul pelarut dalam keadaan uap.Hal ini dapat diilustrasikan dengan contoh Laut Mati, di mana konsentrasi garam yang tinggi mengakibatkan penurunan tekanan uap pelarut. Pada tahun 1878, kimiawan Prancis, Marie Francois Raoult, menemukan bahwa tekanan uap jenuh larutan dapat dihitung dengan mengalikan fraksi mol pelarut dengan tekanan uap jenuh pelarut murni, yang dikenal sebagai Hukum Raoult.
Rumus penurunan tekanan uap dapat ditulis sebagai ΔP = P0 - P, di mana P0 adalah tekanan uap zat cair murni dan P adalah tekanan uap larutan.
2. Kenaikan Titik Didih (ΔTb)
Penambahan zat terlarut ke dalam pelarut akan menyebabkan kenaikan titik didih larutan. Hal ini terjadi karena adanya penurunan tekanan uap yang mengakibatkan diperlukannya suhu yang lebih tinggi agar tekanan uap larutan sama dengan tekanan atmosfer.Kenaikan titik didih adalah perbedaan suhu antara titik didih larutan dengan titik didih pelarut murni. Ini disebabkan oleh partikel-partikel zat terlarut dalam larutan yang menghalangi penguapan partikel-partikel pelarut, sehingga membutuhkan energi tambahan.
Perbedaan titik didih larutan dengan titik didih pelarut murni di sebut kenaikan titik didih yang dinyatakan dengan “ΔTb”. Persamaannya dituliskan sebagai:
ΔTb = kb × m
ΔTb = kb × (gram ÷ Mr) × (1000/P)
ΔTb = Tb larutan – Tb pelarut
Dimana: ΔTb = kenaikan titik didih (oC); kb = tetapan kenaikan titik didih molal (oC kg/mol); m = molalitas larutan (mol/kg); Mr = massa molekul relatif; P = jumlah massa zat (kg).
3. Penurunan Titik Beku (ΔTf)
Penambahan zat terlarut ke dalam larutan akan menyebabkan penurunan titik beku. Zat terlarut mengganggu pembentukan struktur kristal padat dari pelarut, sehingga diperlukan suhu yang lebih rendah agar larutan dapat membeku.Penurunan titik beku adalah perbedaan suhu antara titik beku larutan dengan titik beku pelarut murni. Persamaannya dituliskan sebagai berikut:
ΔTf = kf × m
ΔTf = kf × (gram ÷ Mr) × (1000/P)
ΔTf = Tf larutan – Tf pelarut
Dimana: ΔTf = penurunan titik beku (oC); kf = tetapan perubahan titik beku (oC kg/mol); m = molalitas larutan (mol/kg); Mr = massa molekul relatif; P = jumlah massa zat (kg).
4. Tekanan Osmotik (π)
Tekanan osmotik adalah gaya yang diperlukan untuk menahan pergerakan zat pelarut melalui membran semipermeabel dari dua jenis larutan yang konsentrasinya berbeda. Ini terjadi karena perbedaan konsentrasi zat dalam larutan, seperti larutan yang lebih encer ke larutan yang lebih pekat.Menurut rumus Van't Hoff, tekanan osmotik (Π) larutan dapat dihitung dengan rumus Π = M × R × T, di mana M adalah molaritas larutan, R adalah tetapan gas (0,082), dan T adalah suhu mutlak.
Contoh soal
1. Volume air yang diperlukan untuk melarutkan 4,9 gram H2SO4 yang konsentrasinya 0,25 m (Ar H = 1; S = 32; O =16) adalah ….Jawab:

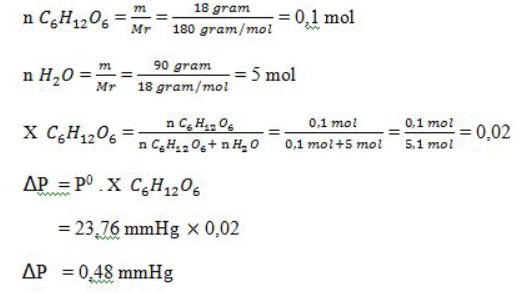
2. Tekanan uap jenuh air pada temperatur 25oC adalah 23,76 mmHg. Tentukan penurunan tekanan uap jenuh air, jika ke dalam 90 gram air dilarutkan 18 gram glukosa (C6H12O6)!
Jawab:
Itulah penjelasan soal sifat koligatif larutan. Semoga informasi ini bermanfaat yaa. (Shofiy Nabilah)
| Baca juga: Belajar Hukum Faraday, Ini Pengertian, Bunyi, Rumus, dan Contoh Soalnya |
Cek Berita dan Artikel yang lain di
Google News



















