Hukum Faraday adalah sebuah hukum yang ditemukan oleh Michael Faraday, seorang ahli kimia dan fisika asal Inggris. Melansir laman Quipper, hukum ini tidak hanya digunakan dalam ilmu Kimia saja, tapi juga ilmu Fisika.
Pengertian Hukum Faraday
Hukum Faraday adalah hukum yang menjelaskan tentang hubungan antara jumlah listrik yang digunakan dengan massa zat yang dihasilkan, baik di katode maupun anode pada proses elektrolisis. Hukum ini ditemukan oleh Michael Faraday, seorang ahli kimia dan fisika asal Inggris pada tahun 1834.Hukum Faraday menjadi salah satu hukum yang memiliki sumbangsih yang besar terhadap kemajuan listrik. Hukum ini juga tidak hanya digunakan dalam ilmu Kimia saja, tapi juga ilmu Fisika.
Bunyi Hukum Faraday
Hukum Faraday dibagi menjadi dua, yaitu hukum Faraday 1 dan hukum Faraday 2. Berikut bunyi hukum Faraday 1:“Massa zat yang dilepaskan selama elektrolisis berbanding lurus dengan jumlah listrik yang digunakan”. Sementara itu, hukum Faraday 2 berbunyi “Massa zat yang dilepaskan pada elektrolisis berbanding lurus dengan massa ekuivalen zat itu”.
Sejarah Hukum Faraday
Penemuan hukum Faraday bermula pada saat Michael Faraday berhasil menemukan pengaruh elektromagnetik di tahun 1831. Penemuannya ini dianggap sebagai penemuan monumental karena memiliki artian penting dalam pengertian teoritis tentang elektromagnetik yang dapat digunakan untuk sebagai penggerak arus listrik secara terus-menerus seperti yang diperagakan oleh Michael Faraday sendiri.Setelah menemukan elektromagnetik, ilmuwan asal Inggris ini melakukan percobaan di bidang Kimia. Faraday akhirnya menemukan adanya hubungan antara jumlah listrik yang digunakan dengan massa zat yang dihasilkan, baik di katode maupun anode pada proses elektrolisis pada tahun 1834.
Tak hanya itu saja, Michael Faraday juga menemukan dua hukum elektrolisis yang menjadi dasar elektrokimia, yaitu hukum Faraday 1 dan hukum Faraday 2. Faraday juga banyak mempopulerkan istilah-istilah kimia, seperti elektroda, elektrolit, anoda, katoda, dan sebagainya.
Rumus Hukum Faraday
Selain memiliki bunyi yang berbeda, hukum Faraday 1 dan 2 juga memiliki rumus yang berbeda. Adapun rumus hukum Faraday 1 dan 2 adalah sebagai berikut.Rumus Hukum Faraday 1
G ≈ Q atau G ≈ it
Keterangan:
G = massa yang dihasilkan pada elektrolisis (gram)
i = arus listrik (ampere)
t = waktu (detik)
Q = muatan listrik dalam sel (Coulomb)
Rumus Hukum Faraday 2

Keterangan:
ME = massa ekivalen
x = jumlah elektron yang diterima atau dilepaskan
Jika rumus hukum Faraday 1 dan 2 ini digabungkan, maka akan diperoleh rumus baru, yaitu:
G = k . i . t . ME
Keterangan:
k = tetapan/faktor pembanding
Faraday menemukan bahwa harga faktor pembanding ini adalah 1/96.500, sehingga rumus di atas dapat dituliskan sebagai berikut.
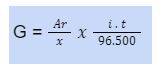
di mana :
G = massa yang dihasilkan pada elektrolisis (gram)
i = arus listrik (ampere)
t = waktu (detik)
ME = massa ekivalen
Ar = massa atom relatif
x = jumlah elektron yang diterima atau dilepaskan
Penerapan Hukum Faraday
Hukum Faraday banyak digunakan dalam berbagai bidang industri. Berikut adalah beberapa contoh penerapan hukum yang ditemukan oleh Michael Faraday ini dalam kehidupan sehari-hari:1. Produksi Zat atau Bahan-bahan Kimia
Zat atau bahan-bahan kimia yang sering digunakan dalam industri, laboratorium, maupun dalam kehidupan sehari-hari ternyata banyak dihasilkan melalui proses elektrolisis. Contohnya, pembuatan gas oksigen, hidrogen, atau gas klorin di laboratorium.2. Pemurnian Logam Kotor
Penerapan hukum Faraday berikutnya adalah pada proses pemurnian logam kotor. Pemurnian logam ini dilakukan dengan cara elektrolisis.Caranya adalah dengan menyusun logam kotor sebagai anode dan logam murni sebagai katode dalam larutan CuSO4 sebagai larutan elektrolitnya. Dari proses pemurnian logam kotor ini akan menghasilkan logam tunggal murni.
3. Penyepuhan Logam
Penyepuhan adalah pelapisan logam dengan logam lainnya melalui proses elektrolisis. Tujuannya adalah untuk melindungi logam tersebut dari korosi sekaligus memperindah penampilan logam. Contohnya, penyepuhan alat-alat makan dengan perak atau emas.Jangan lupa ikuti update berita lainnya dan follow akun google news Medcom.id
| Baca juga: Mengenal Antoine Lavoisier: Penemu Hukum Kekekalan Massa yang Sempat Salah Jurusan |
Cek Berita dan Artikel yang lain di
Google News



















