Pengertian Titik Didih
Dilansir dari situs Zenius, titik didih dapat dideskripsikan sebagai tekanan uap pada sebuah zat cair yang sama dengan tekanan eksternal dari zat cair. Mungkin, banyak dari kalian yang bertanya-tanya mengapa air selalu mencapai titik didihnya pada suhu 100°C. Ketika air mencapai 100°C, hal itu setara dengan 760mmHg yang merupakan tekanan normal pada udara sekitar. Maka dari itu, tidak heran bahwa air tetap bisa mendidih apabila kita mengubah tekanan pada sekitar air.Rumus Titik Didih
Kenapa ya, ketika kalian ingin merebus kentang pada air mendidih, malah air berubah menjadi tidak mendidih. Ternyata, peristiwa ini terjadi lantaran air memerlukan pemanasan lebih sehingga ia dapat mencapai titik didih kembali dengan campuran kentang didalamnya. Perubahan titik didih air dengan titik didih campuran tersebut diartikan sebagai kenaikan titik didih.Kenaikan titik didih dapat dirumuskan seperti:
ΔTb : Tb Larutan-Tb Pelarut
Keterangan:
Tb larutan = titik didih larutan
Tb pelarut murni = titik didih pelarut (misal air : 100° C)
?Tb = kenaikan titik didih
Selain itu, terdapat hubungan antara kenaikan titik didih dengan konsentrasi larutannya. Peristiwa tersebut dapat dinyatakan dalam rumus:
Δ+Tb = Kb . m
Dalam larutan yang bersifat menghantarkan listrik atau elektrolit, persamaan rumus diatas berubah menjadi:
Tb = Kb . m [ 1 + ( n – 1 ) a]
Keterangan
Δ+Tb: Kenaikan titik didih (Tb larutan – Tb pelarut)
m: molalitas/molal larutan (mol per 100 gram pelarut)
Kb: Tetapan kenaikan titik didih molal (°C) atau konstanta ebulioskopi, yaitu kenaikan titik didih untuk 1 mol zat dalam 1000 gram pelarut
n: jumlah ion dalam larutan yang dihasilkan dari setiap satuan rumus kimia senyawa terlarut
a: derajat ionisasi (untuk larutan elektrolit kuat secara umum nilainya dianggap = 1)
Tabel Konstanta Titik Didih
Ternyata, setiap zat cair di muka bumi ini memiliki titik didih yang berbeda-beda, lho Sobat Medcom! Berikut Tabel Konstanta Didih Setiap Benda!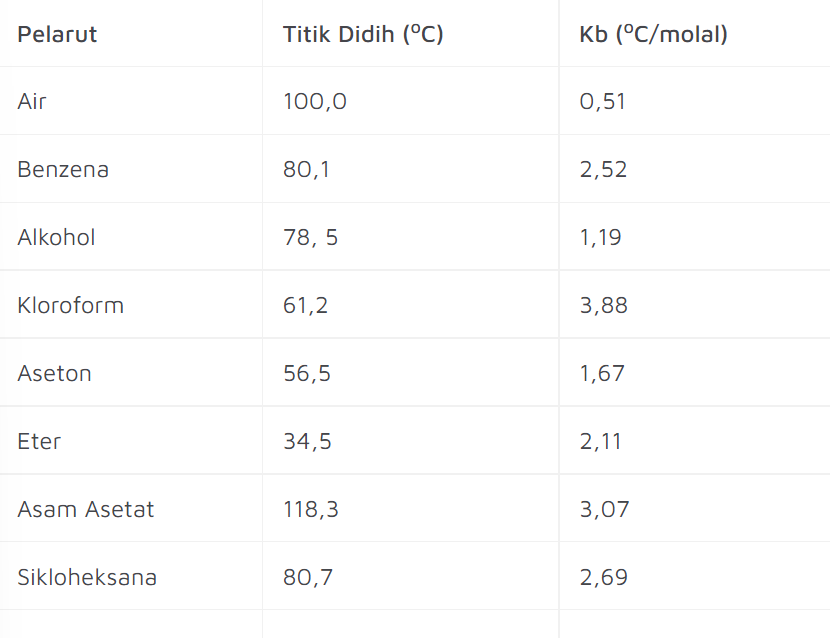
Gimana Sobat Medcom? Sekarang, kalian jadi belajar banyak mengenai titik didih suatu zat cair, kan? Buat kalian yang ingin tahu banyak seputar sains atau dunia pendidikan lainnya, jangan lupa untuk terus ikuti Medcom, ya! (Gracia Anggellica)
| Baca juga: 7 Perbedaan Sel Volta dan Sel Elektrolisis |
Cek Berita dan Artikel yang lain di
Google News



















