Apa itu Sel Volta dan Sel Elektrolisis
Dilansir dari laman resmi Quipper, sel elektrolisis merupakan sel elektrokimia yang mengubah energi listrik menjadi energi kimia melalui proses penguraian senyawa elektrolit. Contohnya dalam proses penyepuhan emas. Ternyata, sel satu ini ditemukan oleh Michael Faraday, ilmuwan asal Inggris yang mana penemuannya ini membuat ia dijuluki sebagai Bapak Listrik.Sedangkan, sel volta ditemukan oleh Alessandro Volta dan Luigi Galvani – ilmuwan asal italia. Maka kalian tidak perlu heran kalau sel volta bisa juga disebut sebagai sel galvani. Sel ini merupakan jenis sel elektrokimia yang dapat mengubah energi kimia menjadi energi listrik, seperti baterai.
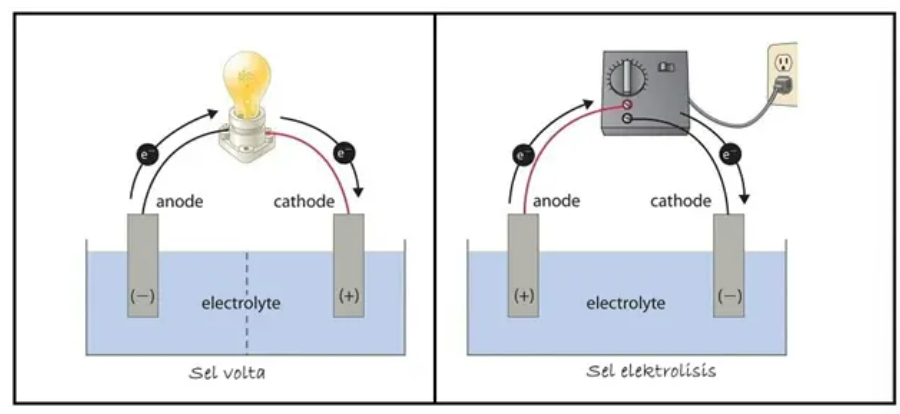
Berikut tujuh perbedaan sel volta dan sel elektrolisis:
1. Jenis Muatan Elektroda
1. Sel Volta → KPAN (Katoda Positif Anoda Negatif)Penjelasan singkat: Dalam sel volta sendiri, anoda bermuatan negatif sedangkan katoda bermuatan positif.
2. Sel elektrolisis → KNAP (Katoda Negatif Anoda Positif)
Penjelasan singkat: Kebalikan dari sel volta, dalam sel elektrolisis, anoda bermuatan negatif sedangkan katoda bermuatan positif.
Hal ini terjadi lantaran elektroda anoda terhubung dengan kutub positif power supply, sedangkan katoda sebaliknya.
2. Jenis Reaksi
Dalam arus listrik, reaksi sel elektrolisis terjadi secara tidak spontan. Maka dari itu, ia membutuhkan energi listrik dari luar untuk menggerakkan elektronnya. Berbeda halnya dengan sel volta yang reaksinya timbul secara spontan, sehingga ia tidak memerlukan energi listrik dari luar. Oleh karena itu, reaksi pada sel volta murni melalui peristiwa reduksi oksidasi (redoks).3. Ada Tidaknya Jembatan Garam
Dalam rangkaian sel volta, terdapat jembatan garam yang berfungsi menjaga mautan cairan elektrolit sehingga tetap netral. Apabila cairan elektorlit netral, maka proses redoks dapat berjalan terus-menerus sehingga menghasilkan arus listrik. Sedangkan, sel elektrolisis tidak memiliki jembatan garam lantaran sumber energi listrik yang ia dapatkan berasal dari luar, yakni power supply. Sumber listrik tersebut yang membuat pererakan ion-ion pada cairan elektrolit. Ion negatif akan bergerak mendekati anoda, lalu ion positif akan bergerak mendekati katoda.4. Potensial Sel Standar
Lantaran memiliki jenis reaksi yang berbeda, sel volta memiliki potensial sel standar positif – karena sifatnya yang spontan. Sedangkan, sel elektrolisis memiliki potensial sel standar negatif.5. Arah Aliran Elektron
Arah aliran elektron pada kedua sel tersebut juga berbeda. Melalui peristiwa redoks, sel volta akan melaju secara spontan – memicu aliran elektron dari anoda bermuatan negatif menuju katoda bermuatan positif. Sedangkan, elektron pada sel elektrolisis yang dihasilkan dari power supply akan mengalir ke katoda. Dari katoda, elektron tersebut akan mengalir melalui larutan elektrolit menuju ke anoda yang bermuatan positif.6. Perubahan Energi:
1. Sel volta: berawal dari reaksi kimia (reduksi oksidasi) yang mengakibatkan aliran elektron dari anoda ke katoda. Aliran tersebut nantinya akan menghasilkan kuat arus listrik – yang mana dalam peristiwa ini terjadi perubahan energi kimia menjadi listrik.2. Sel elektrolisis: berawal dari sel yang dialiri arus listrik, menyebabkan aliran elektron dari power supply menuju katoda, sehingga aliran elektroda menjadi bermuatan negatif. Akibatnya, ion positif dalam cairan elektrolit akan bergerak mendekati katoda kemudian mengalami reduksi. Selanjutnya, ion negatif akan bergerak menuju anoda dan mengalami oksidasi. Dalam peristiwa ini, energi listrik akan berubah menjadi energi kimia.
7. Kegunaan
Tidak hanya dari jenisnya, ternyata fungsi dari kedua sel tersebut juga memiliki perbedaan besar. Dalam bentuk baterai, sel volta biasanya digunakan sebagai sumber arus listrik pada perangkat elektronik, seperti radio, remote tv, mainan anak-anak, dan lainnya. Sementara itu, pada proses penyepuhan emas, pemurnian logam, serta pembuatan beberapa jenis gas dalam industri merupakan kegunaan dari sel elektrolisis.Fun fact! Meski memiliki jenis dan kegunaanya yang berbeda, namun kedua sel tersebut bisa ditemukan dalam satu perangkat saja, lho! Contohnya dalam penggunaan handphone. Pada saat baterai telepon genggam kalian di-charge, maka terjadi reaksi pada sel elektrolisis, seedangkan ketika selesai di-charge, maka akan timbul reaksi sel volta. Keren banget, kan?
Sobat Medcom ingin mengenal lebih lanjut mengenai pengetahuan alam lainnya atau ingin tahu pengetahuan seputar dunia pendidikan lainnya? Jangan lupa untuk selalu mengikuti Medcom, ya!
(Gracia Anggellica)
| Baca juga: Serba Serbi Hidrogen, Unsur Kimia Paling Ringan |
Cek Berita dan Artikel yang lain di
Google News



















