Dilansir dari laman resmi Quipper, termokimia dapat didefinisikan sebagai ilmu yang membahas perubahan kalor pada suatu materi yang disebabkan oleh adanya reaksi kimia atau fisika. Dalam bab ini, kalian juga akan mengenal istilah sistem dan lingkungan.
Sistem merupakan tempat terjadinya suatu reaksi kimia sedangkan lingkungan sendiri dapat dijelaskan sebagai segala sesuatu di luar sistem. Tidak hanya itu, kalian juga akan mempelajari mengenai entalpi serta menentukan entalpi sistem.
Biar semakin paham, ini dia 10 contoh soal latihan mengenai Termokimia serta pembahasannya:
1. Soal 1
Ketika bensin mengenai telapak tangan kita, maka akan terasa dingin dan berangsung-angsur mengering. Pernyataan yang benar terkait keadaan di atas adalah…A. Bensin adalah sistem yang berperan dalam penyerapan kalor dari lingkungan
B. Kalor berpindah dari kulit telapak tangan ke bensin
C. Bensin berperan sebagai sumber kalor
D. Kulit tangan menyerap kalor dari bensin
E. Bensin melepaskan kalor untuk menguap
Pembahasan:
Apabila kalian meneteskan bensin pada telapak tangan, pastinya akan terasa dingin. Hal ini terjadi lantaran bensin menyerap kalor dari telapak tangan kalian. Kalor yang diterima bensin dari telapak tangan nantinya akan digunakan untuk menguap. Dalam kasus ini, bensin berperan sebagai sistem penyerap kalor sedangkan telapak tangan berperan sebagai sumber kalor tersebut.
Sehingga, jawaban dari pertanyaan di atas adalah A. Bensin merupakan sistem yagn berperan menyerap kalor dari lingkungan.
2. Soal 2
Sebuah sistem mengalami perubahan energi dalam 650 J. Apabila sitem tersebut melakukan pekerjaan sebesar 120 J, maka dapat disimpulkan bahwa…A. Sistem menyerap kalor sebesar 530 J
B. Sistem melepaskan kalor sebesar 530 J
C. Sistem menyerap kalor sebesar 770 J
D. Sistem melepaskan kalor sebesar 770 J
E. Sistem menyerap kalor sebesar 520 J
Pembahasan:
Diketahui:
?E = 650 J
W = – 120 J (melakukan kerja)
Ditanya: keadaan sistem =…?
Jawaban:

Lantaran Q nilainya positif, maka keadaan sistem menyerap kalor. Berdasarkan perhitungan di atas, maka dapat disimpulkan bahwa jawaban dari pertanyaan di atas ialah C. Sistem menyerap kalor sebesar 770 J.
3. Soal 3
Perhatikan persamaan reaksi termokimia berikut ini: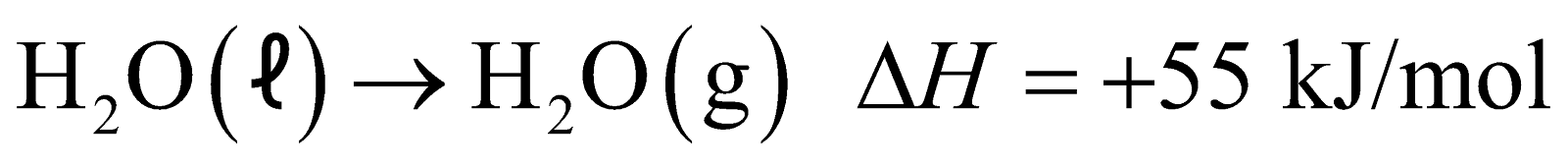
Besarnya kalor untuk menguapkan 3,6 gram H2O adalah …. (Ar H = 1, O = 16)
A. 37,5 kJ
B. 27,5 kJ
C. 42 kJ
D. 110 kJ
E. 98 kJ
Pembahasan:
Diketahui:
m = 3,6 gr
Ar H = 1
Ar O = 16
Ditanya: Q = …?
Jawaban: berdasarkan reaksi yang tertera pada pertanyaan, diketahui penguapan 1 mol H2O membutuhkan kalor sebesar 55kJ. Pertama-tama, kalian harus mengetahui jumlah mol pada 3,6 gr H2O.

Lalu, tentukan besarnya kalor untuk menguapkan 0,5 mol H2O.

Jadi, dapat disimpulkan bahwa besar kalor untuk menguapkan 3,6 gram H2O adalah B. 27,5 kJ.
4. Soal 4
Diketahui, kalor pembakaran 4 mol gas butana (C4H10) adalah -2.440 kJ. Kalor pembakaran 17,4 gram butana adalah … (Ar C = 12, H = 1).A. -221 kJ
B. 183 kJ
C. -178 kJ
D. 178 kJ
E. -183 kJ
Pembahasan:
Diketahui:
n = 4
?H = -2.440 kJ
Ar C = 12
Ar H = 1
Ditanya: Q untuk 17,4 gram butana = …?
Jawaban:
Pertama, kalian perlu mengetahui jumlah 17,4 gram butana.

Lalu, tentukan kalor pembakaran 0,3 mol butana.

Maka, dapat disimpulkan bahwa kalor pembakaran 17,4 gram butana adalah E. -183 kJ.
5. Soal 5
Perhatikan reaksi pembakaran asetilena berikut:
Diketahui entalpi pembentukan standar CO2 (g) = y kJ/mol dan C2H2 (g) = z kJ/mol. Entalpi pembentukan standar untuk H2O() adalah ….
A. (x - 2y + z) kJ/mol
B. (2x + y + z) kJ/mol
C. (x - y + 2z) kJ/mol
D. (x - y + z) kJ/mol
E. (x + y + z) kJ/mol
Pembahasan:
Diketahui:

6. Soal 6
Perhatikan reaksi berikut.CH4(g) → C(g) + 4H(g) ?H = 1.212 kJ/mol
Tentukan besarnya energi ikatan antara atom C dan H!
Pembahasan:
Dalam pertanyaan di atas, kalian diminta untuk menentukan energi ikatan antara atom C dan H. Energi ikatan dapat didefinisikan sebagai energi yang dibutuhkan untuk memutuskan ikatan antara kedua atom tersebut. Pada soal, ?H = 1.212 kJ/mol – disimpulkan bahwa pemutusan 4 ikatan C – H menghasilkan perubahan entalpi sebesar 1.212 kJ/mol. Maka dari itu, besar energi ikatan untuk memutuskan 1 ikatan antara atom C dan H ialah 303 kJ.
7. Soal 7
Dalam suatu penelitian, pembakaran 20 gram zat A mampu memanaskan 160 gram air dari suhu 20 oC sampai 70oC. Pembakaran 1 mol zat A tersebut dsertai dengan pelepasan kalor sebesar 210 kJ. Apabila, efisiensi kalor pada penelitian tersebut dibuat sebesar 80%, maka berapa besar massa molekul relatif zat A? (c air = 4,2J/goC).Pembahasan:
Diketahui:
Mair = 160 gram
MA = 20 gram
?T = 70OC - 20oC = 500C
C air = 4,2 J/goC
Ditanya: Mr A = …?
Jawaban:
Pertama, cari tahu besar kalor yang dihasilkan dari pembakaran zat A

Kemudian, tentukan banyaknya mol zat A yang terbakar.

Terakhir, cari tahu Mr A dengan menggunakan persamaan berikut ini.

Maka, dari perhitungan di atas, dapat disimpulkan bahwa massa molekul relatif zat A adalah 100.
8. Soal 8

Berdasarkan aturan hukum Hess terkait diagram di atas, berapa nilai ?H2?
Pembahasan:
Hukum Hess menginterpretasikan bahwa besar kalor yang diserap (masuk) dan dilepaskan (keluar) tidak bergantung pada jalan reaksinya namun ia bergantung pada kondisi awal dan akhir. Maka dari itu, perubahan entalpi awal = perubahan entalpi akhir. Secara matematis, dapat dituliskan seperti:

Sehingga, nilai dari ?H2, ialah -350 kJ/mol.
9. Soal 9
2SO2 (g) + O2 (g) –? 2SO3 (g)Apabila perubahan entalpi pembentukan standar SO2(g) dan SO3(g) berturut-turut ialah sebesar -295 kJ/mol dan -396kJ/mol, tentukan perubahan entalpi pembentukan reaksi tersebut!
Pembahasan:

Jawaban:
Untuk mendeterminasi perubahan entalpi reaksi, sebaiknya kalian menggunakan persamaan berikut ini.

Berdasarkan perhitungan di atas, perubahan entalpi reaksi ialah -1.087 kJ/mol.
Soal 10

Berdasarkan diagram di atas, berapakan perubahan entalpi untuk menguraikan 1 mol air hingga menjadi unsur-unsur bebasnya?
Pembahasan:
Pada diagram di atas, terdapat tanda panah mengarah ke bawah di mana tanda tersebut menggambarkan reaksi pembentukan air dari unsur-unsur bebasnya. Perubahan entalpi dari reaksi pembentukan air tersebut ialah sebesar -484 kJ/mol.
Sedangkan, besaran yang dipertanyakan pada soal ialah perubahan entalpi penguraian. Sebelumnya, pasti kalian telah mengetahui pembentukan merupakan kebalikan dari penguraian. Oleh karena itu, perubahan entalpi untuk menguraikan 1 mol air menjadi unsur-unsur bebasnya adalah +484 kJ/mol.
Nah itu dia tadi pengertian dan soal-soal serta pembahasan terkait materi Termokimia. Semangat belajarnya, Sobat Medcom!
| Baca juga: Memahami Titik Didih Zat Cair |
Cek Berita dan Artikel yang lain di
Google News



















