FITNESS & HEALTH
BPOM Berikan Pendapat Terkait Obat Tak Penuhi Standar Bisa Tersebar
Medcom
Kamis 24 November 2022 / 20:51
Jakarta: Kasus gagal ginjal akut di Indonesia tidak bisa dianggap sepele. Penyakit ini diduga adanya cemaran dari Etilen Glikol (EG) dan Dietilen Glikol (DEG) yang melewati ambang batas pada obat-obatan sirop.
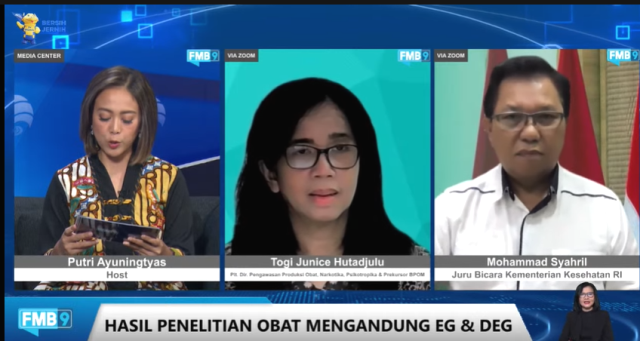
Karena adanya cemaran tersebut, masyarakat tentu bertanya-tanya, mengapa obat tercemar yang tidak memenuhi standar bisa lolos tersebar? Direktur Pengawasan Produksi Obat, Narkotika, Psikotropika, dan Prekursor BPOM, Apt Dra. Togi Junice Hutadjulu, MHA, memberikan pendapat.
Togi berpendapat bahwa BPOM memiliki otoritas dan standar yang sama dengan regulator obat di seluruh dunia, yaitu melakukan pengawasan sepanjang produksi. Pengawasan tersebut dari pre-market hingga post-market.
“Kita bekerja berdasarkan regulasi. Kita interview, evaluasi semua yang akan disummit saat peredarannya, termasuk fasilitas diproduksi yang kita pastikan sudah memenuhi,” kata Togi pada diskusi media daring, Kamis, 24 November 2022.
Pada pre-market, pihak BPOM melakukan pencegahan dengan membuat regulasi dan standar produksi. BPOM juga berikan izin edar saat proses telah dinyatakan memenuhi standar. Namun, industri farmasi juga memiliki kewajiban yang tercantum pada undang-undang.
.png)
(Direktur Pengawasan Produksi Obat, Narkotika, Psikotropika, dan Prekursor BPOM, Apt Dra. Togi Junice Hutadjulu, MHA mengatakan BPOM memiliki otoritas dan standar yang sama dengan regulator obat di seluruh dunia, yaitu melakukan pengawasan sepanjang produksi. Foto: Dok. Istimewa)
“Kewajiban industri farmasi untuk memastikan obat diproduksi dan diedarkan, keamanan, khasiat dan mutu, tanggung jawab mereka,” ujarnya.
Proses ini tidak bisa dilihat setiap hari, namun Togi menyebut bahwa semuanya sudah memiliki ketentuan dalam produksi dan juga standar pedoman bagaimana membuat obat yang baik.
Pada kasus mengenai industri farmasi yang diketahui memiliki obat-obatan tercemar, BPOM turun ke lapangan dan melakukan pengujian ulang pada bahan baku. Pada pengujian tersebut yang membuat produksi tidak memenuhi syarat, namun sudah diberi izin edar.
“Jadi, misalkan kami setelah mendapatkan izin edar, kami juga datang melakukan surveillance ke sarana. Tetapi, tidak bisa dalam 365 hari di situ,” kata Togi. “Itu menjadi tanggung jawab produsen,” lanjutnya.
Sejauh ini ada lima produsen obat yang dilaporkan dan terkena kasus pidana. Dalam artikel Medcom.id sebelumnya, "Bertambah, Ini Daftar 5 Perusahaan Farmasi yang Langgar Ketentuan Pembuatan Obat Sirop," disebutkan pelaku pelanggaran ketentuan Cara Pembuatan Obat yang Baik/CPOB di antaranya:
1. PT Yarindo Farmatama
2. PT Universal Pharmaceutical Industries
3. PT Afi Farma
4. PT Samco Farma
5. PT Subros Farma
Togi pun menyebut karena lima perusahaan ini menciptakan obat-obatan dengan cemaran yang berbahaya, mereka diberikan sanksi administratif berupa pencabutan sertifikat pembuatan obat yang baik.
Aulia Putriningtias
Cek Berita dan Artikel yang lain di

(TIN)
Karena adanya cemaran tersebut, masyarakat tentu bertanya-tanya, mengapa obat tercemar yang tidak memenuhi standar bisa lolos tersebar? Direktur Pengawasan Produksi Obat, Narkotika, Psikotropika, dan Prekursor BPOM, Apt Dra. Togi Junice Hutadjulu, MHA, memberikan pendapat.
Togi berpendapat bahwa BPOM memiliki otoritas dan standar yang sama dengan regulator obat di seluruh dunia, yaitu melakukan pengawasan sepanjang produksi. Pengawasan tersebut dari pre-market hingga post-market.
“Kita bekerja berdasarkan regulasi. Kita interview, evaluasi semua yang akan disummit saat peredarannya, termasuk fasilitas diproduksi yang kita pastikan sudah memenuhi,” kata Togi pada diskusi media daring, Kamis, 24 November 2022.
Pada pre-market, pihak BPOM melakukan pencegahan dengan membuat regulasi dan standar produksi. BPOM juga berikan izin edar saat proses telah dinyatakan memenuhi standar. Namun, industri farmasi juga memiliki kewajiban yang tercantum pada undang-undang.
.png)
(Direktur Pengawasan Produksi Obat, Narkotika, Psikotropika, dan Prekursor BPOM, Apt Dra. Togi Junice Hutadjulu, MHA mengatakan BPOM memiliki otoritas dan standar yang sama dengan regulator obat di seluruh dunia, yaitu melakukan pengawasan sepanjang produksi. Foto: Dok. Istimewa)
“Kewajiban industri farmasi untuk memastikan obat diproduksi dan diedarkan, keamanan, khasiat dan mutu, tanggung jawab mereka,” ujarnya.
Proses ini tidak bisa dilihat setiap hari, namun Togi menyebut bahwa semuanya sudah memiliki ketentuan dalam produksi dan juga standar pedoman bagaimana membuat obat yang baik.
Pada kasus mengenai industri farmasi yang diketahui memiliki obat-obatan tercemar, BPOM turun ke lapangan dan melakukan pengujian ulang pada bahan baku. Pada pengujian tersebut yang membuat produksi tidak memenuhi syarat, namun sudah diberi izin edar.
“Jadi, misalkan kami setelah mendapatkan izin edar, kami juga datang melakukan surveillance ke sarana. Tetapi, tidak bisa dalam 365 hari di situ,” kata Togi. “Itu menjadi tanggung jawab produsen,” lanjutnya.
Sejauh ini ada lima produsen obat yang dilaporkan dan terkena kasus pidana. Dalam artikel Medcom.id sebelumnya, "Bertambah, Ini Daftar 5 Perusahaan Farmasi yang Langgar Ketentuan Pembuatan Obat Sirop," disebutkan pelaku pelanggaran ketentuan Cara Pembuatan Obat yang Baik/CPOB di antaranya:
1. PT Yarindo Farmatama
2. PT Universal Pharmaceutical Industries
3. PT Afi Farma
4. PT Samco Farma
5. PT Subros Farma
Togi pun menyebut karena lima perusahaan ini menciptakan obat-obatan dengan cemaran yang berbahaya, mereka diberikan sanksi administratif berupa pencabutan sertifikat pembuatan obat yang baik.
Aulia Putriningtias
Cek Berita dan Artikel yang lain di
Google News
(TIN)