Proton adalah partikel bermuatan listrik positif yang terdapat di dalam inti atom, sedangkan neutron ialah partikel inti atom yang tidak bermuatan listrik. Adapun elektron didefinisikan sebagai partikel bermuatan listrik negatif yang mengelilingi proton dan neutron.
Lantaran berukuran sangat kecil, massa atom tidak bisa ditentukan dengan cara ditimbang. Partikel ini diukur menggunakan spektrometer massa, yaitu alat rekayasa teknologi yang mampu menentukan massa partikel-partikel kecil seperti atom.
Namun, seiring berkembangnya ilmu pengetahuan, massa atom kini bisa diketahui tanpa harus mengukur dengan alat khusus. Ini bisa ditentukan dengan cara membandingkan massa suatu atom dan massa atom standar.
Hasil dari perhitungan yang demikian dikenal dengan sebutan massa atom relatif. Massa atom relatif disimbolkan dengan Ar dan tidak memiliki satuan.
Teori atom Bohr menyebut atom-atom dari unsur tertentu di alam dapat memiliki massa berbeda. Untuk itu, massa atom relatif dari suatu unsur dihitung berdasarkan massa atom rata-rata dari keseluruhan isotop stabil yang terdapat di alam dibandingkan dengan massa atom standar.
Adapun atom yang digunakan sebagai standar ialah atom karbon (C-12). Hal ini sebagaimana yang ditentukan oleh International Union of Pure and Applied Chemistry (IUPAC).
Melansir laman Ruangguru, atom C-12 digunakan sebagai standar karena memiliki isotop yang paling banyak terdapat di alam dan paling stabil. Isotop adalah atom yang memiliki nomor atom sama, tetapi nomor massanya berbeda.
Karena atom C-12 digunakan sebagai standar, maka satuan massa atom didefinisikan sebagai suatu massa yang besarnya sama dengan seperdua belas massa satu atom C-12. Untuk lebih jelasnya, berikut rumus massa atom relatif alias rumus Ar:
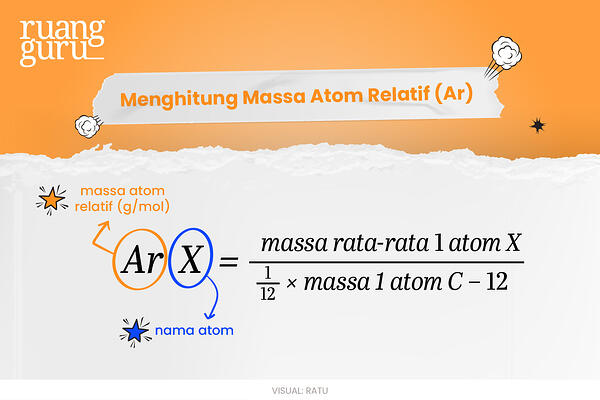
Berdasarkan rumus di atas, diketahui bahwa massa atom rata-rata dari setiap unsur mesti ditketahui terlebih dahulu sebelum menentukan Ar. Hal ini dikarenakan atom-atom unsur yang sama, tidak selalu mempunyai massa yang sama.
Massa atom rata-rata dari suatu unsur X dapat dirumuskan sebagai berikut:

Keterangan:
% isotop 1 = kelimpahan isotop pertama
% isotop 2 = kelimpahan isotop kedua
massa isotop 1 = massa atom isotop pertama
massa isotop 2 = massa atom isotop kedua
Jika ada lebih dari dua isotop, maka bisa menggunakan perkalian yang sama dengan isotop pertama dan kedua.
Demikianlah sekilas pembahasan mengenai partikel atom beserta rumus untuk menghitung massa atom relatif. Semoga bermanfaat! (Nurisma Rahmatika)
Baca: Kupas Tuntas Rumus Empiris dalam Kimia
Cek Berita dan Artikel yang lain di
Google News



















